肿瘤微生物组,仍在持续引发着人们的关注!
近日,由弗雷德·哈钦森癌症中心的Christopher D. Johnston和Susan Bullman领衔的团队,再次向我们展示了肿瘤微环境中微生物发挥的重要作用。
研究团队对口腔鳞癌(OSCC)和结直肠癌(CRC)样本中微生物的空间分布进行了全面的分析,发现这些微生物在肿瘤组织内并非是随机分布的,而是呈现出高度组织化结构。进一步研究也表明,这些组织化分布的微生物与肿瘤侵袭以及免疫抑制密切相关,这为将来可能的药物研发与干预治疗提供了新的靶点。
该研究首次阐明了微生物空间分布与肿瘤发展之间的联系,促进了我们对肿瘤微生物组的认识。相关成果发表于顶级期刊《自然》上[1]。

论文首页截图
肿瘤不单单由肿瘤细胞组成,在肿瘤内部及肿瘤周围,存在着大量非肿瘤细胞及组织,它们共同组成了复杂的肿瘤微环境(TME)。
在TME中,包括细菌、真菌等在内的各种微生物又组成了肿瘤微生物组。此前的研究已经在至少33种主要的癌症类型中观察到了微生物群落的存在[2],它们在肿瘤的发生发展、转移以及免疫逃逸等方面均发挥着重要作用[3]。
在这项研究中,研究人员们首先对来自11名CRC患者的44块组织(每名患者4块组织)进行了16S rRNA测序分析,通过聚类分析,研究人员发现,有4名肿瘤患者的样本有着相对稳定的微生物组成,而剩余的大多数患者(7人)的样本则呈现出不同程度的微生物组成异质性。这也表明,这些患者肿瘤中微生物的分布存在着空间异质性。
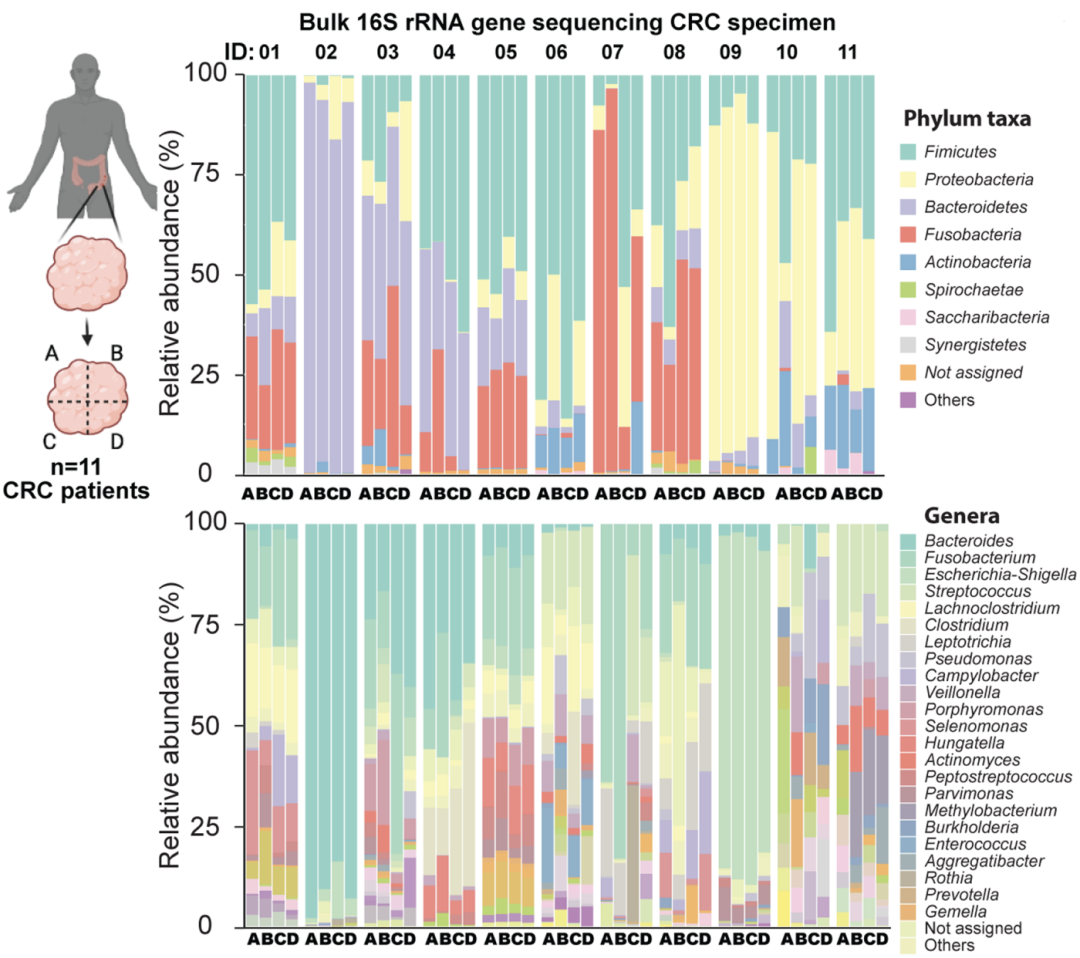
11名CRC患者样本的微生物种属分布
在此前的研究中,受限于研究技术,人们对肿瘤组织中微生物群落的空间分布及其产生的实际影响一直未能有深入了解。为了解决上述问题,在这个研究中,研究人员进行了方法上的改良。
具体来说,研究人员开发了一种名为RNA scope-FISH的技术,从原理上讲,该技术利用上述测序分析识别出的微生物特征性转录本序列作为特定微生物的分子标识符(UMI),随后通过设计互补的荧光探针,就可以实现微生物空间分布的可视化及其载量的简单量化。
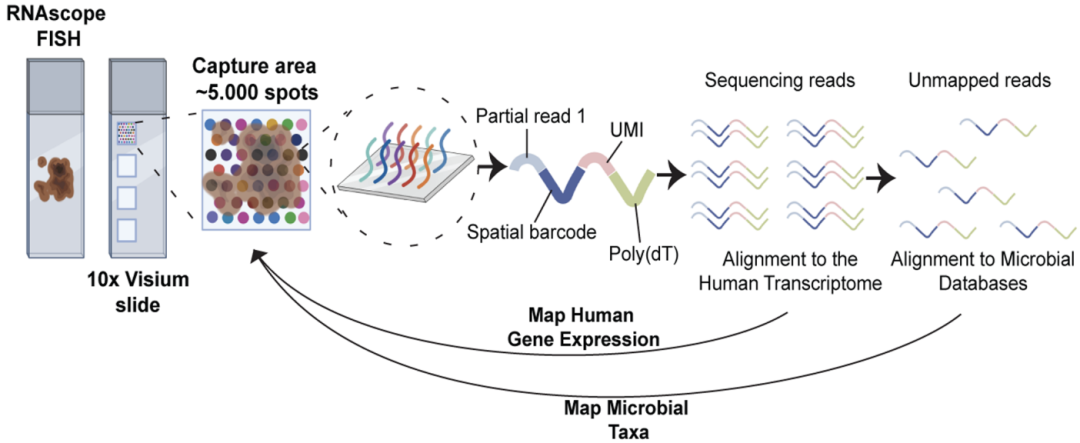
RNA scope-FISH技术的原理图
研究结果表明,在28%的OSCC以及46%的CRC患者样本中均观察到了细菌的转录本。
不同OSCC肿瘤中细菌种属的数量从1种到42种不等(中位数为8),主要优势菌属为小单孢菌(Parvimonas)、不解糖嗜胨菌(Peptoniphilus)以及梭杆菌属(Fusobacterium)。
不同CRC肿瘤中的细菌种属数量则从1种到31种不等(中位数为2),主要优势菌属为梭杆菌属和拟杆菌属(Bacteroides)。
另外,不同种属的细菌在肿瘤组织中还呈现出一定的空间共定位,这也说明TME中的不同微生物之间可能有复杂的相互作用关系。

OSCC和CRC患者肿瘤样本中微生物的空间分布
接下来,为了确定这些呈高度组织化分布的细菌对TME的功能是否有实际作用,研究人员又用到了一种叫做GeoMx DSP的技术,该技术可通过抗原-抗体结合以及寡核苷酸测序分析实现多靶点的空间原位共分析。
在这里,研究人员使用CD45等蛋白作为肿瘤TME中免疫细胞的识别靶标,使用PanCK、SMA等作为上皮细胞的识别靶标。通过对相同肿瘤中有细菌(Bac+)和无细菌(Bac-)区域的比较分析,研究人员发现,Bac+区域表现出明显的免疫抑制特征,例如,CD4和CD8的表达水平降低,而免疫抑制分子如CTLA-4、ARG1以及CD66b则发生了显著富集。
这些结果表明,微生物对于TME的影响与其空间分布存在着明显的相关性。

肿瘤相关微生物对TME功能的影响
进一步研究中,研究人员又从细菌与细胞间相互作用方式的角度进行了研究,RNA scope FISH的结果表明,细菌可能粘附于细胞的表面,也可能进入到细胞内部,这种相互作用方式的差异可能会导致不同的影响。
另外,他们还应用了INVADE-seq来分析细菌对宿主细胞转录组的影响。结果表明,不同类型的细胞常常会与不同种属的细菌发生相互作用,例如,梭杆菌与密螺旋体常常与上皮细胞和单核细胞来源的巨噬细胞v1细胞簇相关。
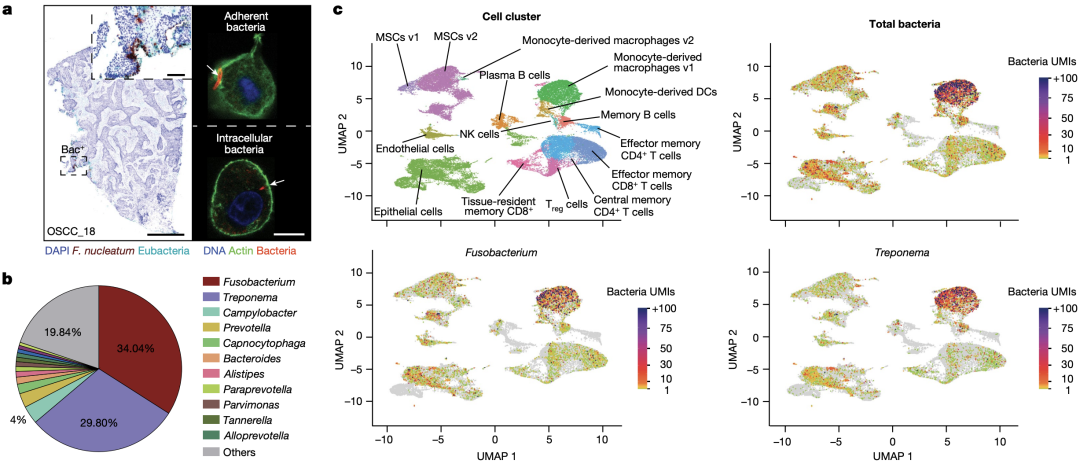
肿瘤相关细菌与宿主细胞类型间的对应关系
另外,分析结果还表明,这种相互作用往往会导致宿主细胞转录组的变化。例如,上皮细胞簇3被鉴定为癌细胞群,在被细菌感染后,该类细胞中EMT、缺氧以及干扰素响应等,与癌症发生发展相关的信号通路均发生了上调。
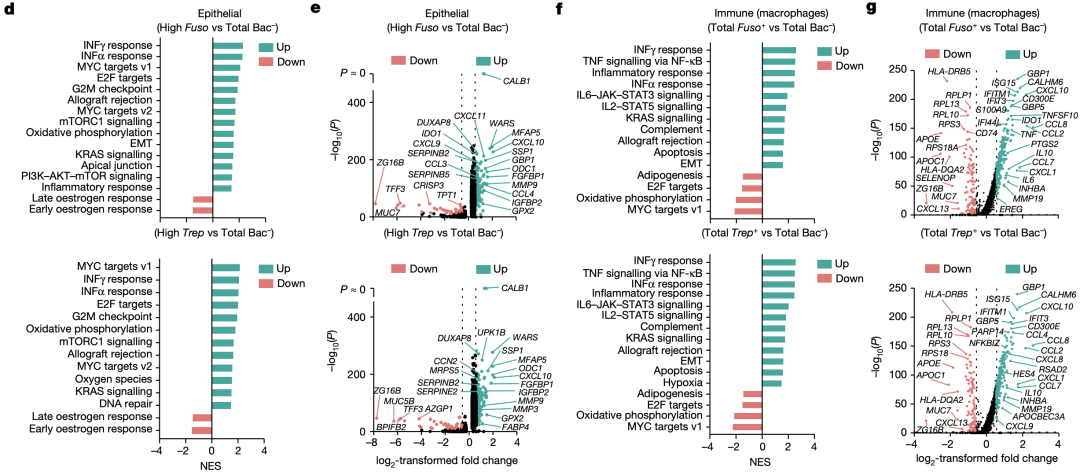
肿瘤相关细菌对宿主细胞转录组的影响
接下来,研究人员又对细菌引发免疫逃逸的具体机制进行了探究,在这里研究人员将研究对象锁定在一种叫做具核梭杆菌(F. nucleatum)的口腔细菌上。
上面的研究表明,具核梭杆菌不仅与ORCC这样的口腔肿瘤相关,与CRC这样的胃肠道肿瘤也有着密切联系,因而研究人员猜想这种细菌可能对TME免疫特征的塑造起到关键作用。
具体实验中,通过3D细胞培养技术,研究人员分别构建了受到(F. nucleatum+)和未受到具核梭杆菌(F. nucleatum-)感染的CRC细胞球状体,再将这些球状体嵌入到均匀分布有中性粒细胞的基质中进行共培养。通过活细胞共聚焦显微镜进行持续观察,研究人员发现,在含有具核梭杆菌的CRC球状体中,中性粒细胞的移动速度较低,且容易形成簇状结构。
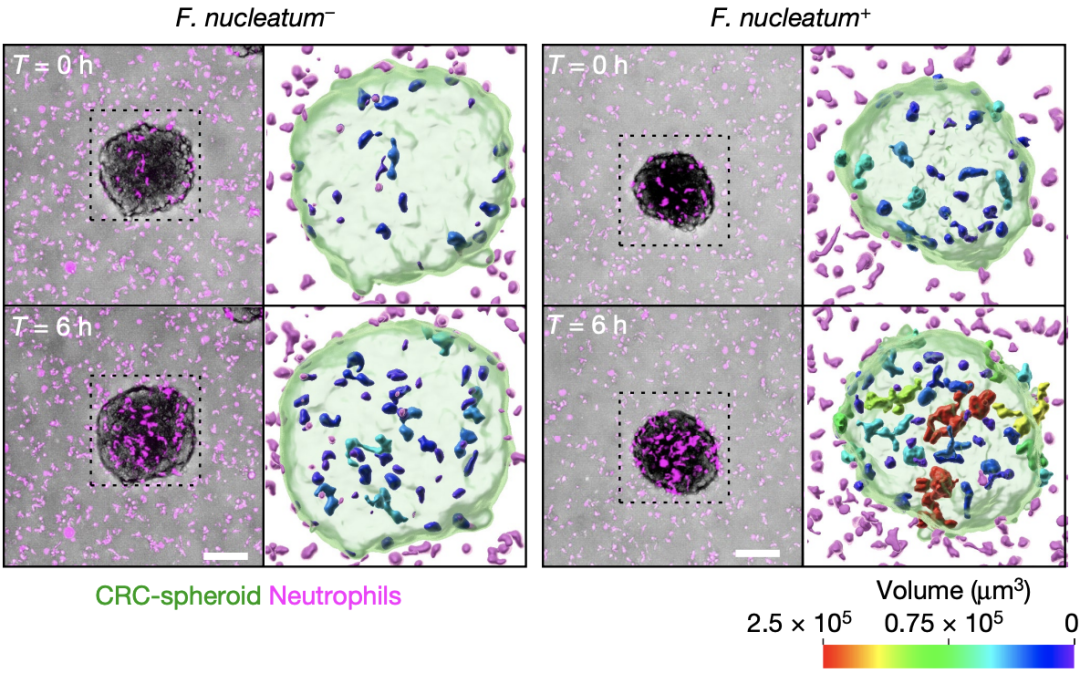
具核梭杆菌对中性粒细胞运动性的影响
此前的研究表明,中性粒细胞对于肿瘤微环境的塑造有着多方面的作用[4]。
一方面,中性粒细胞可以通过分泌趋化因子如CCL2、CCL17等来招募调节性T细胞(Treg),而Treg又可以通过抑制其它炎性T细胞(如CD8+T细胞)群来促进肿瘤生长。
另一方面,中性粒细胞也能通过向T细胞呈递抗原,刺激适应性免疫反应和IFN-γ的生产来抑制肿瘤生长。
总之,联合上述研究结果我们不难得出结论,具核梭杆菌可能通过影响中性粒细胞的运动模式,进而对肿瘤局部微环境的特征产生影响。
最后,研究人员还发现,含有具核梭杆菌的CRC球状体边缘常常会以单细胞形式发生脱落,脱落下来的单细胞会带着具核梭杆菌向基质中迁移,而不含有具核梭杆菌的CRC球状体则往往不会有单细胞脱落,而是以整体的形式缓慢向周围基质入侵。这表明,具核梭杆菌的存在不仅加速了癌细胞的侵袭,也改变了受感染细胞的运动模式。
转录组分析表明,这种改变主要与负责细胞外基质重塑、细胞转移以及细胞粘附的信号通路的上调以及细胞周期、DNA损伤修复和p53信号通路的下调相关。
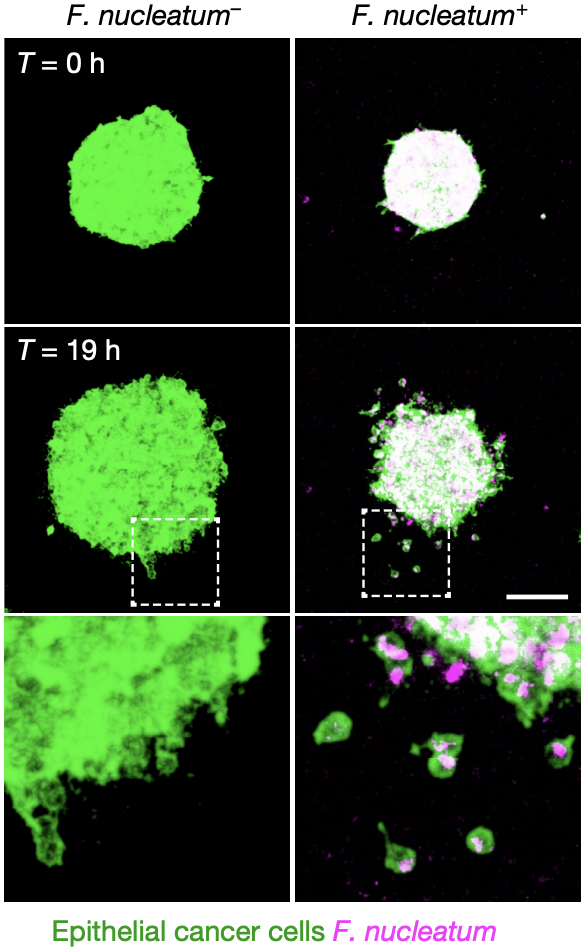
具核梭杆菌对CRC球状体运动模式的影响
总的来说,这项研究应用空间转录组学等先进的分析技术,对两种肿瘤类型中细菌的空间分布特征进行了全面的阐明。其中,对具核梭杆菌这种口腔细菌促癌作用的深入探索也进一步扩展了我们对癌症的认识。
希望将来针对更多癌种的研究能够让我们更好的认识和理解肿瘤微生物组,以及帮助我们找到更多的癌症治疗靶点。
参考文献
[1] Galeano Ni?o JL, Wu H, LaCourse KD, et al. Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer. Nature. 2022;611(7937):810-817. doi:10.1038/s41586-022-05435-0
[2] Nejman D, Livyatan I, Fuks G, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020;368(6494):973-980. doi:10.1126/science.aay9189
[3] LaCourse KD, Johnston CD, Bullman S. The relationship between gastrointestinal cancers and the microbiota. Lancet Gastroenterol Hepatol. 2021;6(6):498-509. doi:10.1016/S2468-1253(20)30362-9
[4] Giese MA, Hind LE, Huttenlocher A. Neutrophil plasticity in the tumor microenvironment. Blood. 2019;133(20):2159-2167. doi:10.1182/blood-2018-11-844548